钯金释氢材料抗癌研究机制【中科院】
氢释放和抗原辅助免疫激活以放大光热疗法的效果。
该材料具有细胞毒效应,能减少热休克蛋白(HSPs)和三磷酸腺苷(ATP),增加活性氧(ROS),导致细胞损伤。
肿瘤抑制和免疫细胞增加,表明氢化钯纳米材料具有良好的肿瘤抑制和免疫激活作用。
传统的光热疗法(PTT)仍然受到热休克蛋白(HSPs)引起的高温耐受和弱免疫反应的阻碍。本文采用两步水热法合成了用于光热免疫治疗的纳米氢化钯 (pdh)。所制备的树突状海胆结构的PdHs不仅能够以超高效(35.7%和43.1%)负载卵清蛋白(OVA)和肿瘤细胞碎片(TF)作为抗原,而且在808 nm激光照射下光热转换效率(36%)和氢释放显著提高。释放的氢气进一步诱导氧化应激和细胞内活性氧(ROS)产生,阻碍线粒体呼吸,最终导致HSPs下调,使细胞对光热疗法敏感。此外,获得的PdHs-TF纳米颗粒在808 nm激光照射下结合光热疗法和TF抗原释放诱导免疫治疗,可以更有效地抑制肿瘤生长。本工作为光热疗法的发展和纳米钯在肿瘤治疗中的多功能应用提供了新的途径。
氢思语:氢气医学对氢气作用的主流看法是选择性抗氧化,虽然有研究发现氢气能产生诱导氧化应激的作用,例如可激活Nrf2的效应,就是这种氧化应激类效应。本研究则发现,纳米钯释放氢气能诱导强烈氧化应激,包括细胞活性氧增加和ATP减少,热休克蛋白减少。这些效应似乎显示出氢气具有细胞毒性的特征,其实非常可能是来自于材料因素。由于氢气来自纳米材料,这些效应也有可能是在生物环境下,纳米钯释放的是氢原子,而氢原子和氢气不同,能和氧气迅速反应产生自由基。
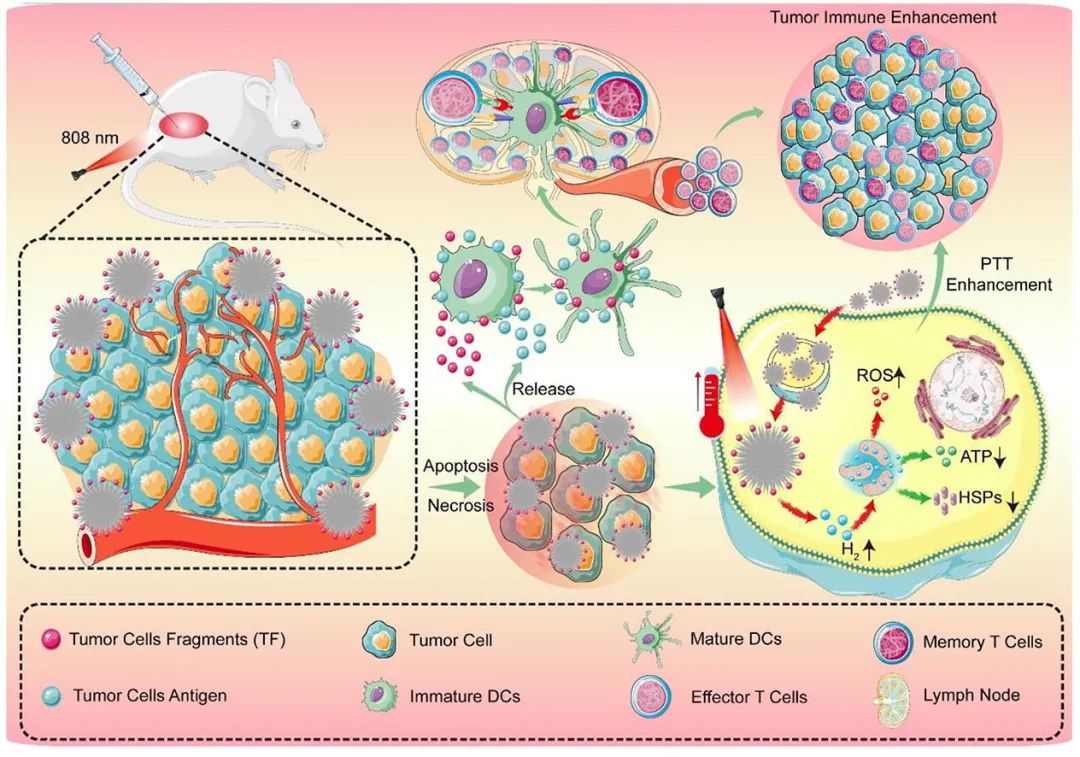
PdHs-TF机理示意图。如方案所示,将PdHs-TF原位注射到小鼠肿瘤中,808 nm近红外产生局部高温。而PdHs-TF通过加热释放氢,导致肿瘤细胞活性氧(ROS)增加,三磷酸腺苷(ATP)和热休克蛋白(HSPs)减少。此外,肿瘤抗原暴露和TF释放诱导小鼠免疫激活,将未成熟树突状细胞(dc)转化为成熟树突状细胞(dc),促进免疫细胞的成熟和分化。最终,光热和免疫联合治疗有效地杀死了肿瘤。
本文发表在顶级期刊《化工杂志》,论文第一作者来自中国科学院长春应用化学研究所稀土资源利用国家重点实验室。
Chen H, Ding B, Tan J, et al. Palladium Hydride Nanourchins with Amplified Photothermal Therapeutic Effects through Controlled Hydrogen Release and Antigen-Assisted Immune Activation[J]. Chemical Engineering Journal, 2022: 136296.




