氢气效应机制最新进展【大泽】
氢气是一种生物抗氧化和抗炎物质。吸入氢气通过缓冲氧化应激显著抑制多个器官的缺血/再灌注损伤。饮用氢水可能有助于缓解神经退行性疾病,包括帕金森病和阿尔茨海默病,从而提高老年人的生活质量。在动物模型中,氢气可抑制脂多糖、刀豆蛋白A、和右旋糖酐硫酸钠诱导的炎症性非传染性疾病,并伴有促炎细胞因子水平的降低。然而,氢气的抗氧化、抗炎等治疗作用不能完全用清除活性氧来解释,因为氢气不能直接减少活性氧。另一方面,动物研究表明,预给药氢气也可以预防炎症性疾病,考虑到氢气不能长时间在体内存留,这更加说明氢气具有间接效应。我们进一步发现,氢气诱导培养的细胞在线粒体中产生轻微的氧化应激,进而诱导抗氧化酶的表达这些结果表明,氢气可以触发线粒体介导的抗氧化应激的保护性适应性反应——线粒体毒性兴奋效应。为了确定氢气的生物学效应的精确分子机制,必须确定氢气生物作用的靶点分子。
包括氢气在内,许多气体分子在脂类中比在水中更容易溶解,脂质中的溶解气体能影响细胞和物理功能。高浓度氮气(N2)增加了细胞脂质双分子层的弯曲模量和稳定性,阻碍了三元脂质双分子层的相分离。虽然麻醉药作用的精确分子机制在很大程度上是未知的,但Meyer-Overton相关性提供了麻醉药气体的效力与其在类脂非极性介质中的溶解度之间的联系。溶解在脂质中的麻醉气体通过疏水相互作用改变细胞膜结构。吸入麻醉剂七氟醚,会在发育期间对小鼠造成脑损伤,这是一种麻醉药物副作用。有趣的是,麻醉药物神经系统损伤可以通过同时吸入氢气得到缓解。
膜通过改变其组成对各种环境扰动作出快速反应。例如,接触氟烷会减少肺泡细胞中磷脂酰胆碱(PC)的合成,这是肺表面活性物质的主要脂质成分。最近有报道称氢气通过抑制脂肪酸过氧化和膜通透性来降低叔丁基过氧化氢的细胞毒性作用,表明氢气影响膜环境和脂质组成。
脂质双分子层是所有细胞膜的主要成分,主要由磷脂形成。磷脂酰胆碱、磷脂酰肌醇(磷脂酰肌醇)和磷脂酰丝氨酸(磷脂酰丝氨酸)主要促进脂质双分子层的形成,而非双分子层形成的磷脂、心磷脂(CL)和磷脂酰乙醇胺(PE)在线粒体呼吸链复合物的组装和活性中具有特定的作用说明磷脂成分的变化对细胞代谢特别是能量的产生有显著影响。此外,磷脂不是细胞膜被动的结构旁观者,而具有调节生理事件的主动作用,如胞质分裂、胞吐和内吞复杂的内体进程仅被部分理解,然而,磷脂在这一过程的各个阶段发挥关键作用是很清楚的。内吞小泡通常与早期内吞体(EEs)融合。早期内吞体成熟为晚期核内体(LEs),与溶酶体融合降解其内容物。各种内吞途径已被确定。一些内容物,如转铁蛋白(Tfn)受体,被早期内吞体分选为循环内小体(REs)并返回到细胞膜霍乱毒素B (CTxB)从循环内小体逆行运输到高尔基体。
本研究旨在研究短时间氢气暴露对培养的人神经母细胞瘤SH-SY5Y细胞脂质组成的影响,因为在氢气存在下的预培养仅3小时就能减少氧化应激诱导的细胞死亡。
我们通过液相色谱-高分辨率质谱分析细胞来确定脂质成分的变化。细胞暴露于氢气 1小时的脂类分析显示甘油磷脂(包括磷脂酰乙醇胺、磷脂酰肌醇和心磷脂)瞬时增加。代谢组学分析还表明,氢气暴露1小时瞬时抑制总能量代谢,并伴有谷胱甘肽的降低。通过特异性抗体染色,我们进一步观察了核内体形态的改变。在氢气暴露的细胞中,霍乱毒素B向位于高尔基体周围的循环内小体的转运被延迟。我们推测,氢气诱导的脂质成分的改变会抑制能量的产生和内小体运输,并伴随氧化应激的增强,从而短暂地刺激应激反应途径来保护细胞。
实验方法
细胞培养后,暴露于氢气。简而言之,SH-SY5Y细胞被保存在含有10%胎牛血清的改性Eagle培养基中。作为对照的N2混合气体含有20% O2, 5% CO2, 75% N2,在丙烯酰胺箱中与传统CO2培养箱中的条件几乎相同。氢气混合气体含20% O2, 5% CO2, 1-50% 氢气,N2构成其余。
这些盒子在一个适当的混合气体的流量1.6升/分钟15分钟在正常压力下。密封,放入培养箱在37°C。孵育后,立即使用特定电极监测培养基中的氢气和O2浓度15分钟。在50% 氢气混合气体下,氢气浓度维持在365±5 μM, O2浓度维持在245±5 μM。在N2混合气体下,氢气浓度无法检测,O2浓度维持在250±5 μM。
将培养的SH-SY5Y细胞在37°C的50% 氢气气体中暴露1和6小时后,用甲醇和氯仿提取细胞脂质。为了确定主要脂质成分的变化,我们使用了液相色谱-高分辨率质谱,可以无偏倚的方式检查生物样品的脂质组特征。我们同时定量了15种脂类,包括磷脂、神经节苷脂和二酰基甘油(DAG),按细胞数量归一化。PCA显示氢气处理和对照细胞中有明显的脂质种类聚类[图1]。
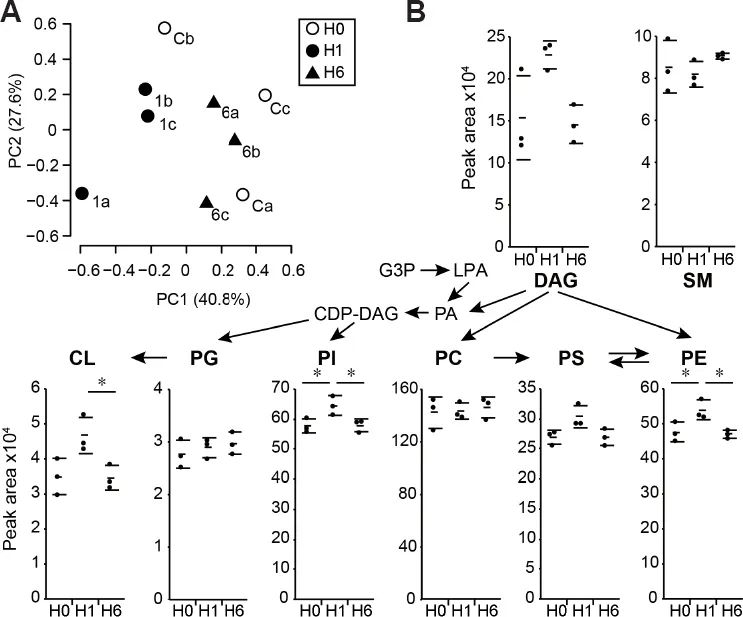
氢气-1小时处理的细胞的PE、心磷脂和磷脂酰肌醇水平显著高于对照组和氢气-6小时处理的细胞[图1]B,而每个细胞的所有脂质的总和没有差异。氢气处理细胞的磷脂酰丝氨酸也倾向于有一个暂时性的增加水平。然而,氢气曝光并没有改变PC的比例,这是最丰富的磷脂,但磷脂胆碱显著增加。此外,两组间游离脂肪酸或甘油三酯也无显著差异(数据未显示)。心磷脂仅在线粒体中合成,主要定位于线粒体内膜(IMM),并与PE协同维持线粒体活性。氢气处理后的细胞DAG水平趋于升高[图1]B, DAG是通过磷脂酸去磷酸化产生的,用于合成PC和PE。
氢气暴露引起的代谢组学变化
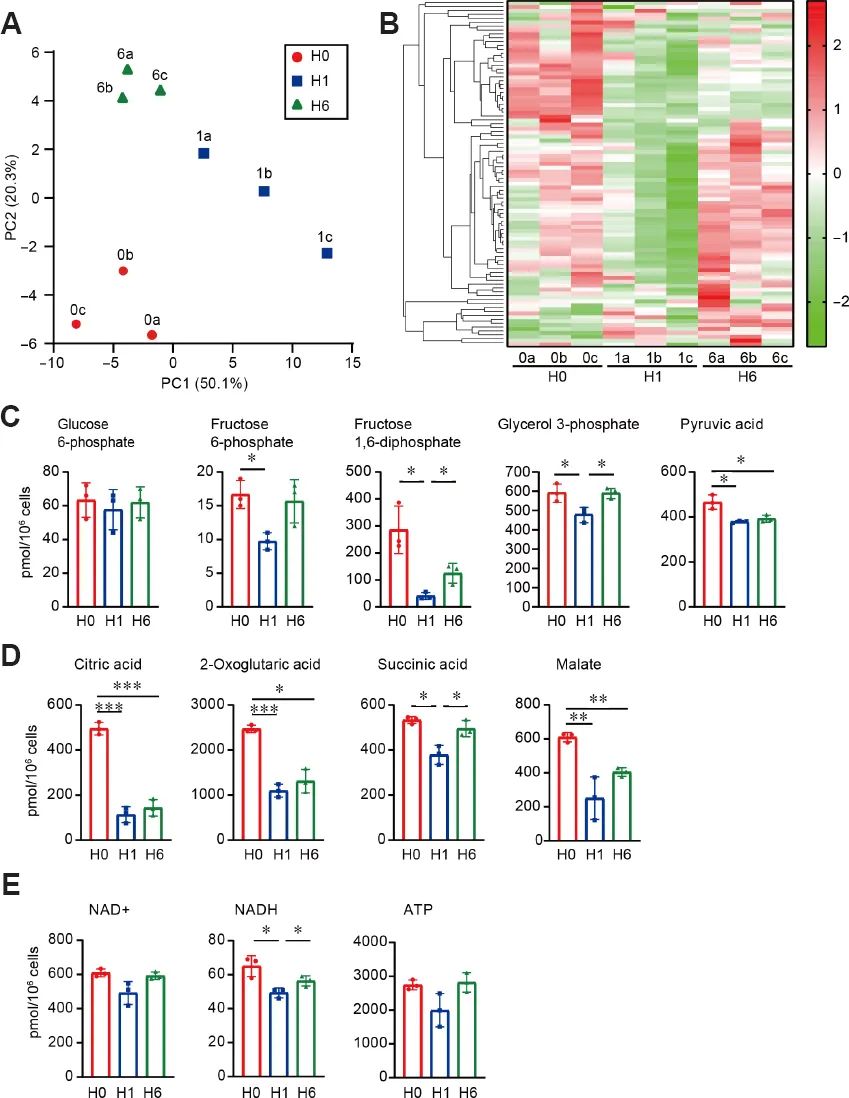
线粒体中心磷脂和PE的组成影响呼吸链功能并改变能量代谢。事实上,我们之前观察到氢气暴露显著改变了线粒体膜电位和细胞耗氧量,同时谷胱甘肽降低。采用代谢组学方法分析氢气作用1和6小时后SH-SY5Y细胞的早期氢气诱导变化。我们选择了116种代谢产物(52种阳离子和64种阴离子),它们参与糖酵解系统、磷酸戊糖途径、三羧酸循环、尿素循环、多胺和肌酸代谢途径、嘌呤代谢途径、谷胱甘肽代谢途径、烟酰胺代谢途径、胆碱代谢途径,以及各种氨基酸代谢途径。PCA比较了对照组细胞和氢气处理1小时和6小时的细胞的代谢组学变化,结果显示,氢气处理导致了不同的代谢组学变化[图3]。
如图3所示,通过分层聚类分析的代谢组学图谱。在氢气暴露的细胞中发现了一些特征性的变化。氢气处理1h后,大部分代谢物水平下降。这些包括糖酵解代谢产物(果糖6-磷酸、果糖1,6-二磷酸、甘油醛3-磷酸、二羟基丙酮磷酸、甘油3-磷酸、3-磷酸甘油酸、2-磷酸甘油酸、丙酮酸和乳酸)[图3]C,三羧酸循环代谢产物(柠檬酸、2-氧戊二酸、琥珀酸、和苹果酸)[图3]D,以及一些氨基酸(甘氨酸、蛋氨酸、酪氨酸和缬氨酸)。果糖1,6-二磷酸经醛缩酶代谢为二羟基丙酮磷酸和甘油醛3-磷酸,这三种代谢物的水平显著降低。氢气作用1小时后,细胞中烟酰胺腺嘌呤二核苷酸(NAD)水平显著降低,三磷酸腺苷(ATP)水平趋于下降[图3]。6小时后,许多这些下调的代谢物的水平,包括降低的烟酰胺腺嘌呤二核苷酸和三磷酸腺苷,恢复到对照组细胞的水平。然而,丙酮酸和三羧酸循环代谢物的水平仍然下降。氢气处理1小时或6小时后,还原/氧化烟酰胺腺嘌呤二核苷酸比值未变,乳酸/丙酮酸和苹果酸/Asp比值显著降低。这些结果表明,氢气暂时抑制了整体代谢,但可持续抑制线粒体能量代谢。
对这一研究的讨论
短时间暴露于氢气可以瞬间增加培养的神经母细胞瘤细胞中磷脂的水平,包括CL、PE和磷脂酰肌醇[图1]。所有类磷脂的合成都始于两种前体,磷脂酸和DAG,氢气也能瞬间提高内质网中DAG水平。甘油3-磷酸是甘油脂质的关键前体,包括三酰甘油、DAG和磷脂。然而代谢组学发现,在氢气暴露后,甘油3-磷酸水平显著且短暂下调[图3]。因此可以推测,短时间暴露氢气可能会干扰磷脂分解代谢途径,包括磷脂酶。这些酶大部分是可溶的,并以一种短暂的方式与细胞膜相互作用需要进一步的研究来阐明氢气暴露导致磷脂增加的分子机制。
与其他细胞器相比,心磷脂和PE的水平在线粒体(特别是IMM)中显著升高,它们的水平在氢气暴露后显著和短暂升高[图1]心磷脂合成酶催化IMM中PG和胞苷二磷酸-DAG生成心磷脂。线粒体生物发生因子调节心磷脂合成酶的表达和活性PE在内质网中通过胞苷二磷酸-乙醇胺途径合成。短时间暴露氢气有增加磷脂酰丝氨酸水平的趋势[图1]。磷脂酰丝氨酸也是线粒体PE的重要前体,由IMM.中的线粒体磷脂酰丝氨酸脱羧酶产生抑制磷脂酰丝氨酸脱羧酶可改变线粒体膜组成,引起生物能量损害心磷脂、PE和磷脂酰丝氨酸由于倾向于形成非双分子层结构,可以通过与目标蛋白形成分子相互作用或通过调节膜的体积特性来影响线粒体功能。因此,我们推测氢气诱导的心磷脂、PE和磷脂酰丝氨酸升高影响能量代谢。
代谢组学数据显示,氢气暴露1小时会暂时抑制整体代谢,而在6小时后几乎恢复[图3]。然后我们认为氢气诱导的瞬时和可逆的磷脂增加与这种代谢紊乱有关。值得注意的是,细胞仍然暴露在50%的氢气中6小时。产生瞬态效应的一个可能原因是氢气的生理功能与氢气加入后的非均匀分布有关,氢气的高扩散率使其迅速丧失。Ito 等的发现支持了这种可能性,即间歇性暴露于氢气气体可以预防大鼠帕金森氏病,而连续暴露则不能。(氢思语:按照这个说法,氢水饮用是间歇性用氢气。比连续吸入,间歇吸入氢气是比较理想的给氢气方法。因为这种方法导致细胞内氢气浓度的波动,这种氢气波动可以对细胞代谢产生应激反应,而持续作用会弱化这种效应。这种作用特点类似于许多预适应效应,如间歇低氧和间歇高氧)
众所周知,细胞膜性质的结构和动态变化是由气体分子的不均匀分布引起的。例如,氙原子,挥发性麻醉气体,优先定位在脂质双分子层的疏水核心,导致每脂质面积和双分子层厚度的增加我们发现线粒体的能量代谢被持续抑制至少到6小时。这表明暴露于氢气会导致线粒体中更多的应激。
氢气处理1小时显著降低了谷胱甘肽的积累,降低了谷胱甘肽氧化还原比[图4]。激活核因子-红系因子2相关因子2 (Nrf2)可诱导谷胱甘肽的合成。之前报道过,SH-SY5Y细胞暴露于氢气会增加线粒体超氧化物的产生,伴随着Nrf2转位进入细胞核,并提高由Nrf2调节的抗氧化酶的表达,这表明氢气诱导的线粒体氧化应激会激活Nrf2我们还证明,氢气给药后,在脂多糖处理的小鼠肝脏中,减少氧化应激的Keap1-Nrf2被激活在正常小鼠中,添加2% 氢气气体可以抑制98%氧负荷引起的肺功能紊乱,但在nrf2敲除小鼠中没有作用我们的结果表明,瞬时氢气诱导的磷脂增加和整体代谢抑制可能通过激活Keap1-Nrf2通路而产生抗氧化作用。
多种细胞过程包括内吞、吞噬和自噬均受磷脂酰肌醇 3-磷酸调控,它主要由III类磷酸肌醇3-激酶空泡蛋白分选产生34磷脂酰肌醇合成了包括磷脂酰肌醇 3-磷酸在内的磷酸肌苷,氢气暴露使其水平显著且短暂升高[图1]。(氢思语:PI3K是重要信号分子,也是氢气医学研究的最重要靶点分子。但是过去研究发现氢气对这种分子产生完全相反的改变效应。有时候是增加,有时候是降低。有时间我对这个问题进行专题讨论)
因此,我们推测氢气暴露后脂质组成的变化可能会影响胞吞和内体运输。另一方面,在催化剂存在下,氢化反应可降低了碳氢化合物中的双键,调节了膜的流动性。然而,氢气暴露对磷脂酰肌醇和磷脂酰丝氨酸中的不饱和程度和烃链长度没有影响[图2]。
然后我们发现氢气暴露增加了rab5阳性EEs和rab11阳性REs,而减少了rab7阳性LEs[图5]。小的GTPase Rab5参与液泡蛋白分选34向EEs的募集,[35]和液泡蛋白分选34在核内体成熟过程中负向调节Rab5,可能与氢气暴露对Rab5阳性EEs的影响有关。然而,氢气抑制了内体转运[图6],但不影响网格蛋白依赖性或非依赖性的内吞作用(数据未显示)。CTxB从质膜依次被传输到rab5阳性EEs,然后被传输到rab11阳性REs,最后被传输到高尔基体氢气暴露延迟了CTxB在REs中的积累,CTxB通常位于细胞深处,围绕微管组织中心。氢气暴露可能会延迟运输CTxB ee >值得注意,暴露于2% 氢气足以拖延CTxB积累研究这些结果符合那些在许多动物模型和人类临床试验,获得的报道,吸入~ 2% 氢气气体充分有效治愈疾病。
只有少数研究报道了氢气直接作用靶分子。为了氢气的进一步医疗应用,有必要确定氢气作用的靶点分子。本研究表明,短时间暴露于氢气会瞬间改变细胞脂质含量。然而,氢气是否直接或间接参与脂质代谢尚不清楚。我们以前报道过氦代替氢气不能保护肾缺血-再灌注损伤然而,据报道,其他稀有气体,如氩气和氙,在细胞实验中可减轻细胞死亡,而氦则不能。有趣的是,一些研究表明,包括氙气在内的吸入麻醉药可直接扰乱膜脂的流动性,改变膜脂含量。然后,氢气可能通过类似于吸入麻醉药的机制作用于脂质。我们推测,氢气诱导的脂质组成的改变会抑制内小体运输和能量产生,并伴随氧化应激的增强。另一方面,膜系统的维持,包括质膜的调节和囊泡的运输,消耗大约30%的细胞能量,表明这里提出的生理变化是相互关联的。
本研究发现氢气暴露可短暂和可逆地增加几种磷脂的水平,并轻微干扰内体运输。代谢组学数据还表明,短时间暴露于氢气会暂时抑制涉及能量生产的代谢通路,并同时增加氧化应激,这可能会触发保护性适应性反应。
文章作者来自日本东京都市老年医学研究所大泽郁郎,发表在《医学气体杂志》。他是2007年《自然医学》氢气医学研究论文的第一作者。
氢思语认为,这个研究的核心:1、氢气具有快速细胞效应。1小时暴露可以导致磷脂显著改变。2、氢气对细胞产生的作用是一种氧化应激效应,或者是一种损伤效应。谷胱甘肽含量下降说明氢气可能不是过去认为的那样直接抗氧化,而是温和损伤启动抗氧化抗损伤效应。3、氢气细胞效应如果过分提高,有引起细胞损伤的后果。
Iketani M, Sakane I, Fujita Y, Ito M, Ohsawa I. hydrgeon induced transient upregulation of phospholipids with suppression of energy metabolism. Med Gas Res, 2022 May 24.




