线粒体产氢和癌症发生假说详解
复合体I是线粒体和细菌呼吸链中的第一个酶,催化NADH的氧化和醌的还原。复合体I和4族膜结合[镍铁]氢化酶之间的密切关系表明,复合体I是由可溶性烟酰胺腺嘌呤二核苷酸(NAD+)还原氢化酶与mrp样反向转运蛋白1结合产生的此外,牛线粒体复合物I与细菌NAD+-还原氢化酶具有序列相似性此外,已在高等植物线粒体中检测到氢化酶活性,并且与复合体I密切相关3。根据这些观察和线粒体在真核生物中的普遍存在,人类线粒体复合体I很可能也具有氢化酶活性。另一方面,有氧糖酵解被普遍认为是癌细胞的标志。Warburg最初认为,有氧糖酵解是由线粒体缺陷引起的然而,后来的研究表明,癌细胞仍然表现出一定程度的氧化磷酸化(OXPHOS)以满足细胞的能量需求。其他研究表明,有氧糖酵解可能由癌基因(如c-Myc和缺氧诱导因子[HIF])的上调或p53肿瘤抑制因子的缺失引起。另外,氢化酶活性假说可能解释了为什么癌细胞表现出有氧糖酵解的上调。

一、本文提出的假说
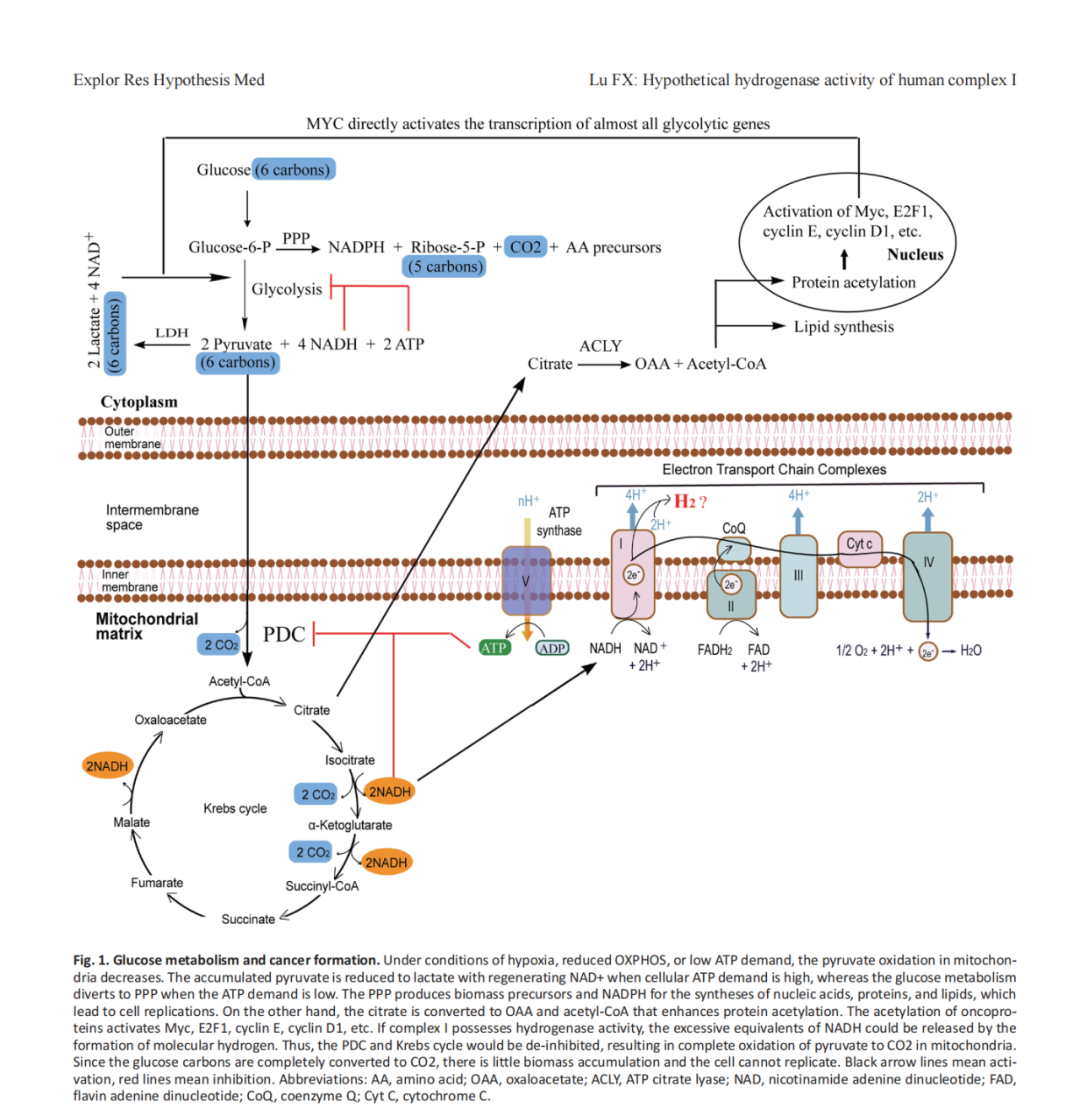
根据复合物I与氢化酶的相似性以及对高等植物复合物I中氢化酶活性的观察,我推测人类线粒体复合物I也可能具有氢化酶活性。失去它很可能导致癌症转化。在缺氧情况下,线粒体氧化磷酸的能力降低,或ATP需求低,电子传递链(ETC)无法氧化与丙酮酸脱氢化酶复合物(PDC)和三羧酸(TCA)循环产生的NADH相同的量。在这种情况下,复合物I的氢化酶活性可以将电子从NADH转移到质子,形成分子氢,并释放过量的NADH还原当量。在失去氢化酶活性的情况下,NADH/NAD+比值增加,从而抑制PDC和三羧酸循环,导致丙酮酸盐进入线粒体的数量减少。积累在细胞质中的丙酮酸被乳酸脱氢化酶(LDH)还原为乳酸,伴随再生的NAD+加速糖酵解。6 .糖酵解的激活也可能伴随着生物合成戊糖磷酸途径(PPP)活性的增加另一方面,线粒体中的柠檬酸盐可以被转运到细胞质中以恢复草乙酸盐(OAA)和乙酰辅酶A,从而从头合成脂质和增强蛋白质乙酰化,从而激活癌蛋白。综上所述,这些代谢改变导致了持续的生物量合成和细胞增殖(图1)。因此,降低NADH/NAD+比值、恢复氢化酶活性或增加ATP消耗可能逆转这种转化。
二、线粒体复合物I与细菌氢化酶的相似性
氢化酶存在于细菌、古菌和一些真核生物中人类细胞中是否存在氢化酶尚不清楚。原核生物的原型复合体I可视为14个亚单位的组合,构成外周臂和膜臂。外周臂由7个亚单位(NuoB到G和NuoI)组成。膜臂也由7个亚单位(NuoA, H, J到N)构成长期以来,复合物I与4族氢化酶密切相关。这些氢化酶是膜结合酶,能从细胞质供体接收电子并将质子还原为氢气。已知最简单的4氢化酶是能量转换氢化酶(Ech),由6个亚基EchA到F组成,膜亚基EchA和EchB分别与NuoL和AuoH同源,外周亚基EchC、D、E和F分别与NuoB、C、D和I同源此外,与线粒体复合体I关系最密切的是大肠埃希菌的甲酸氢裂解酶(FHL): 7个亚基FHL-1和10个亚基FHL-2。FHL-2的9个亚基与复合体I的10个亚基同源。此外,复合体I中的醌结合位点似乎与氢化酶中的NiFe活性位点相对应。除原核生物外,牛线粒体复合体I还与细菌NAD+-还原氢化酶有关。牛线粒体复合物I的51-、24-和75-kDa亚单位的蛋白序列在A. eutrophus来源的可溶性NAD+还原氢化酶中都有同源物。
三、高等植物线粒体复合体I的氢化酶活性
据报道,高等植物可以在种子萌发或组织裂解过程中产生氢气叶绿体中的光系统已被证明具有氢气释放活性最近,Zhang等报道了高等植物线粒体中存在一种氢化酶活性,并且与复合体I密切相关。缺氧可以同时促进氢气释放和琥珀酸的积累。作者认为琥珀酸和NADH的增加是线粒体产氢的驱动力。植物产氢至少是为了适应由低氧引起的代谢胁迫,如琥珀酸积累、Q池减少和NADH/NAD+比值的增加,以维持更有效的氧化还原稳态调节值得注意的是,外源性氢气可大大降低动物和人体的氧化损伤15,但氧化应激在癌症形成中的实际作用仍有争议。
四、葡萄糖代谢中复合物I氢化酶活性的意义
葡萄糖通过糖酵解转化为丙酮酸盐,其中大部分在常氧条件下转移到线粒体,并被PDC氧化为乙酰辅酶A和CO2, NAD+还原为NADH。乙酰辅酶A随后进入三羧酸循环,在此循环中被氧化为CO2并还原为NADH。NADH被复合物I氧化生成NAD+。来自NADH和FADH2的电子通过ETC到氧,产生跨线粒体膜的质子梯度。ATP合酶利用这一梯度产生ATP,以满足细胞的能量需求(图1)。
缺氧状态下或静息状态下(ATP需求降低),细胞氧化磷酸化能力降低,ETC无法氧化由PDC和三羧酸循环产生的NADH。NADH/NAD+比值的增加抑制了PDC和三羧酸循环中的所有调节酶。丙酮酸盐氧化被抑制导致丙酮酸盐进入线粒体的数量减少。因此,积累在细胞质中的丙酮酸被LDH还原为乳酸,再生NAD+并加速糖酵解,因为它需要NAD+来维持功能。因为H+/H2的氧化还原电势高于NAD+/NADH和UQ/UQH2(电子从低电势流向高电势),如果复合物I具有氢化酶活性,过量的NADH可以将电子转移到质子形成分子氢,并降低NADH/NAD+比值。最终过量的NADH还原当量以分子氢的形式被释放。没有NADH/NAD+的高比率的限制,即使在缺氧或低容量的OXPHOS下,丙酮酸氧化和三羧酸循环也能维持功能(图1)。(氢思语:缺乏氧气的情况下,代表还原张力的细胞内氢原子(NADH)蓄积,导致还原性负荷增加,如果能变成氢气,氢气比氢原子的优势是能自由扩散,这样就可以解决局部组织还原氢张力过高造成的还原负担问题。菌群在没有氧气的代谢环境下,也能发生这种代谢切换,让氢气肩负电子接受体的角色,实现高效消耗电子的目标)。
五、复合物I氢化酶活性的丧失可导致癌症的形成
癌细胞可能由于复合I基因突变或表观遗传改变而失去氢化酶活性。其缺失可增加NADH/NAD+比值,抑制PDK和三羧酸循环,上调糖酵解和戊糖磷酸途径,增强脂质合成,并通过蛋白质乙酰化激活癌基因。
复合物I氢化酶活性下降导致糖酵解和戊糖磷酸途径的上调带来的系列改变。
1、NADH/NAD+比值增加
在低氧条件下,线粒体内NADH/NAD+比率通常由于电子传递减慢和随之NADH氧化速率降低而增加。我们还观察到,与正常肝细胞相比,一些来自胆管细胞癌和肝细胞癌的细胞系显示出显著较高的NADH水平。
2、NADH抑制PDC和三羧酸循环
NADH/NAD+比值的增加抑制了PDC和Krebs循环(特别是NADH产生反应)的活性。PDC催化丙酮酸盐限速氧化脱羧生成乙酰辅酶A,并将NAD+还原为NADH。PDC活性主要由丙酮酸脱氢化酶激酶(pyruvate dehydrogenase kinases, PDKs)调节。PDK使PDC磷酸化使其活性失活。PDKs通过响应不同的变构调节剂来调节PDC活性。NADH/NAD比值的增加是pdk的强变构激活剂,可关闭PDC活性21三羧酸循环的调节及其与OXPHOS的持续反馈对维持细胞的稳定状态至关重要。NADH抑制三羧酸循环中的所有调节酶。因此,当通过ETC的电子通量减慢时,NADH积累,从而导致三羧酸循环关闭(图1)。
3、有氧糖酵解和戊糖磷酸途径的上调
丙酮酸作为糖酵解的终产物,可以通过LDH转化为乳酸,乳酸的活性受其底物相对浓度的调节。增加的丙酮酸和NADH水平激活LDH产生乳酸和再生NAD+。甘油醛磷酸脱氢化酶(GAPDH)是糖酵解的关键酶之一,NAD+是激活甘油醛磷酸脱氢化酶所必需的。然而,增强的糖酵解本身不足以促进细胞复制。糖酵解使细胞产生ATP,而戊糖磷酸途径产生核糖-5-磷酸、氨基酸前体27和NADPH,用于核酸、蛋白质和脂类的合成。当细胞需要更多的ATP时,丙酮酸被还原为乳酸,并伴有NAD+再生,使糖酵解功能得以保持,为细胞提供ATP。在这些情况下,骨骼肌在运动时产生乳酸,并且大多数患有线粒体疾病(如MELAS)的人有乳酸酸中毒,但癌症发病率并没有较高26在这种情况下,由于缺乏生物量前体,细胞无法复制。当细胞有足够的ATP维持其结构和功能时,升高的ATP水平会抑制糖酵解28,葡萄糖和糖酵解中间产物被转移到戊糖磷酸途径,从而促进生物量合成和细胞复制6因此,糖代谢可能根据细胞的能量需求在糖酵解和戊糖磷酸途径之间波动。这一假设得到了以下证据的支持:戊糖磷酸途径与糖酵解一起协调葡萄糖通量,并支持大分子的细胞生物发生和能量产生糖酵解为细胞提供能量,而戊糖磷酸途径为生物质合成提供前体。如果缺氧或OXPHOS能力降低持续存在,癌细胞可以代谢适应这些环境,并改变表观遗传(癌基因的激活),有利于糖酵解和戊糖磷酸途径。在表观遗传学发生改变后,癌细胞即使在正常氧条件下也可以持续增殖(有氧糖酵解,即所谓的Warburg效应)(图1)。
从中心碳代谢的角度来看,葡萄糖可转化为代谢前体,而代谢前体可用于生成细胞的全部生物量27当丙酮酸在线粒体中未被完全氧化为CO2或在胞质中未被还原为乳酸时,葡萄糖代谢被转移到戊糖磷酸途径, 戊糖磷酸途径中只有1/6的葡萄糖碳被转化为CO2,其余为生物量前体(图1)。随着生物量的积累,细胞的内能(U,取决于它所含物质的量)增加。当内能由于生物量的积累而翻倍时,细胞应该分裂成两个,以便容纳内能水平在生理范围内。因此,癌细胞不受控制地复制。
4、癌症细胞中的柠檬酸盐、乙酰辅酶A和蛋白质乙酰化
除了上调有氧糖酵解和戊糖磷酸途径外,三羧酸循环的中间代谢物在细胞生长和增殖中也发挥着重要作用柠檬酸在三羧酸循环的第一步由乙酰辅酶A和草乙酸盐(OAA)合成,可通过柠檬酸/异柠檬酸载体(CIC)转移到细胞质中,并通过ATP柠檬酸裂合酶(ACLY)将其转化回乙酰辅酶A和草乙酸盐。乙酰辅酶A是脂肪酸和胆固醇内源性生物合成的重要组成部分。癌细胞中脂肪酸合成增加可增强快速增殖癌细胞的膜生物发生另一方面,乙酰辅酶A水平的增加与整体组蛋白和非组蛋白底物(包括癌蛋白)的乙酰化改变相关。
据报道,CIC mRNA水平在多种肿瘤细胞株和人肿瘤细胞中升高,并且在多种肿瘤细胞株中均有升高此外,ACLY在癌细胞中表达上调,抑制ACLY可抑制某些类型癌细胞的增殖。此外,在结肠、乳腺、肺、胃、膀胱、前列腺和肝肿瘤中观察到ACLY的表达和活性显著升高。
乙酰辅酶A是生长和增殖的关键代谢信号。进入生长阶段后,细胞内乙酰辅酶A水平显著增加41癌细胞常表现出乙酰化模式和水平的改变8乙酰化水平由乙酰转移酶和去乙酰化酶活性的平衡调节。有研究表明,赖氨酸乙酰转移酶(KAT)在细胞分化和胚胎发育中发挥重要作用42,并与肿瘤发生有关8MYC在有氧糖酵解调控中发挥关键作用,通过结合经典E-box序列(CACGTG)直接激活几乎所有糖酵解基因的转录。葡萄糖转运蛋白SLC2A1是MYC的作用靶点之一,并被MYC上调以增强葡萄糖摄取。GCN5(一般控制不可解抑制的5)乙酰转移酶对Myc的乙酰化可稳定Myc蛋白。Myc通常与另一个在细胞生长调节中起重要作用的转录因子E2F1协同作用。在小细胞肺癌中,E2F1招募GCN5使H3K9乙酰化,从而促进E2F1、cyclin E和cyclin D1靶基因的转录45,这些靶基因均促进细胞增殖和肿瘤生长。此外,研究表明ACLY的乙酰化通过阻断赖氨酸泛素化而稳定蛋白,导致ACLY蛋白水平升高,脂质生物合成增加和细胞增殖增强。
综上所述,柠檬酸盐可以从线粒体迁移到细胞质,在细胞质中转化为乙酰辅酶A和OAA。乙酰辅酶A能够促进脂质合成和蛋白质乙酰化,激活生长相关基因和蛋白质,包括癌蛋白。
六、讨论
可溶性氢化酶由α、β、γ和δ四个不同的亚单位组成。αγ二聚体是一种NADH氧化还原酶,而其他两个亚单位与氢化酶活性有关。氨基酸序列分析表明,可溶性氢化酶NADH氧化还原酶亚基α和γ与牛线粒体复合体I的51-、24-和75-kDa亚基有相似性,而氢化酶亚基β和δ与牛复合体I无相似性。由于真核复合体I含有多达45个亚基,少数亚基的作用尚未阐明,因此不能排除人复合体I在一定条件下具有氢化酶活性。
人们已经提出了几种癌症转化的理论,但即使是最突出和最被接受的模型(突变理论)也面临着越来越多的实验数据和论据,这些数据和论据要么无法用该模型解释,要么与该模型相矛盾47突变理论无法解释以下事实:存在没有突变的癌症48,以及正常组织可以显示出大量的遗传变化,包括癌症起始基因和癌症驱动基因的变化49Warburg关于OXPHOS紊乱的假说4无法解释遗传性线粒体疾病与癌症形成率增加无关这一事实,即使是在大多数线粒体受到影响的情况下50此外,这两种模式相互矛盾。然而,氢化酶假说可以解释在癌症形成中OXPHOS缺陷、有氧糖酵解和癌基因激活的影响。这一假设可能提供了一个统一的框架,结合了以往不同的模型。
如果人类线粒体确实具有氢化酶活性,那么过量的NADH还原当量可以通过氢化酶活性释放,从而形成分子氢。因此,当细胞处于缺氧、ETC缺陷或ATP消耗低时,释放过量的NADH当量可以阻止细胞恶性转化。降低NADH/NAD+比值、恢复氢化酶活性或增加ATP消耗将逆转这一转变,为抗肿瘤提供新的途径。如果实验证实了这一假说,我们可以利用基因工程技术纠正线粒体基因突变或输入外源性NADH氧化酶,以降低NADH/NAD+比值,维持三羧酸循环的功能。据报道,体力活动可使罹患侵袭性癌症的风险降低10% ~ 20%,癌症生存者全因死亡率的相对风险高达49% 51体力活动和癌症风险之间关系的潜在机制可以用氢化酶假说来解释。由于体力活动消耗大量的ATP, ATP可以通过ETC抑制电子通量,从而增加了OXPHOS活性,使胞质内的丙酮酸盐还原为乳酸盐并转运到细胞外。因此,没有葡萄糖碳积累来支持生物量合成和细胞增殖。因此,政府卫生当局将发起一项运动,促进更多的体育活动,以预防广大人群的癌症发展。
七、未来的展望
首先,人类线粒体复合体I的氢化酶活性必须由实验证实或证伪。如果复合物I确实具有氢化酶活性,我们需要研究复合物I的氢化酶活性如何影响线粒体中的PDC、三羧酸循环和OXPHOS;胞质内糖酵解和戊糖磷酸途径。
其次,重要的是检测癌细胞复合物I是否失去了氢化酶活性,并阐明它是如何在基因突变或表观遗传改变方面失去的。
第三,前面的讨论表明,代谢途径的方向主要是由热力学控制的,而不是动力学控制的,因为酶只会增加反应速度。因此,未来代谢途径的研究将更多关注底物和产物浓度如何改变代谢途径的方向。
八、结论
人线粒体复合物I可能具有氢化酶活性。在低氧、低OXPHOS容量或低ATP需求的条件下,氢化酶活性可以通过将电子从NADH转移到质子形成分子氢来释放过量的NADH还原当量。由于NADH/NAD+比值在低氧磷容量中增加,氢化酶活性的丧失将抑制PDC和三羧酸循环。降低PDC和三羧酸循环的活性导致糖酵解和戊糖磷酸途径的上调,从而导致癌症的形成。相反,恢复氢化酶活性、降低NADH/NAD+比值和(或)增加ATP需求可能会阻止癌细胞的增殖。




